Infecciones resistentes a los antibióticos
- Escrito por Redacción
- Publicado en Bienestar 24 horas
- 0 comentarios
Una creciente cantidad de personas mueren debido a infecciones resistentes a los antibióticos. Son propiciadas por especies bacterianas que mutan a fin de evadir a los fármacos creados para destruirlas. En todo el mundo, murieron más de 1.2 millones debido a este problema de salud (en 2019).
Ante esta situación, un equipo de investigadores del Centro para Medicina Personalizada en Mayo Clinic creó una tecnología de secuenciación a fin de detectar e identificar rápidamente a microbios y fenotipos resistentes a los antibióticos en una sola prueba. El novedoso método de secuenciación de nanoporos aparece publicado en Surgery y mSphere.
También puedes leer. Riesgos de enfermedades cardíacas. https://revistafactorrh.com/pareja-saludable/item/7104-riesgos-de-enfermedades-cardiacas
“Demostramos que la secuenciación de nanoporos sirve para predecir infecciones después de pocas horas de recolectada la muestra y días antes de que el paciente empiece a mostrar síntomas”, dijo la Dra. Emma Whittle, especialista en investigación en el Departamento de Cirugía y autora principal del estudio.
Esto permitiría evitar infecciones mortales al disminuir el tiempo del diagnóstico de días a solamente horas. Además, ayudará a los médicos personalizar mejor los antibióticos, según la infección.
La secuenciación de nanoporos analiza segmentos de ADN o ARN de cualquier longitud. Más aún, la detección de microbianos se puede realizar en cualquier punto del ciclo de secuenciación, lo que permite obtener el diagnóstico sobre los microbios en tiempo real.
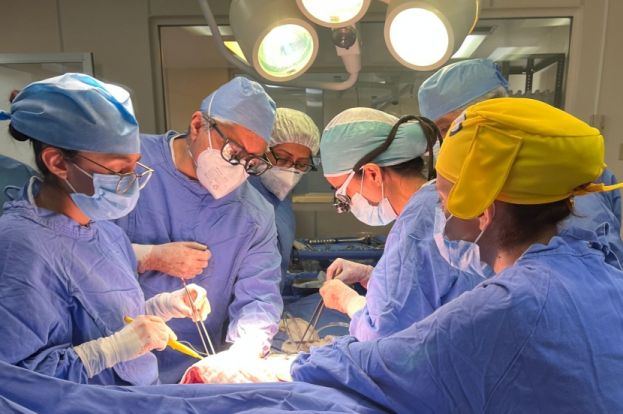
A fin de llevar a cabo el estudio, los científicos realizaron la secuenciación de nanoporos para identificar especies microbianas y fenotipos resistentes a los antibióticos en muestras de bilis pertenecientes a pacientes sometidos a una resección de la cabeza del páncreas.
Las infecciones en el lugar de la cirugía suelen ser una complicación que afecta hasta al 45 por ciento de los pacientes sometidos a este procedimiento y dichas infecciones influyen considerablemente sobre el resultado que obtiene el paciente.
“Logramos identificar a los pacientes con bilis infectada y que corrían peligro de infección en el sitio quirúrgico con una exactitud del 100 por cien, comparado con las técnicas clínicas actualmente empleadas. Nuestra técnica también mejoró la detección de especies micóticas y elevó la cantidad total detectada de especies microbianas y fenotipos resistentes, comparado con las prácticas clínicas estándar”, afirmó la Dra. Whittle.
Las técnicas clínicas estándar incluyen hacer cultivos bacterianos en placas, lo que puede demorar hasta 72 horas. Mientras se espera los resultados, se empieza a administrar al paciente una mezcla preventiva de antibióticos, con la esperanza de que, al menos, uno surta efecto. No obstante, los antibióticos también eliminan a las bacterias intestinales sanas que apoyan al sistema inmunitario, ayudan a la digestión y controlan la inflamación.
La sorpresa para el equipo fue que en todas las muestras de bilis infectada se detectaron genes de resistencia a los antibióticos. “Nuestra teoría es que las bacterias están presentes en el intestino, como parte de la microbiota, y cuando los pacientes se someten a una intervención quirúrgica, se produce una alteración y algunas bacterias escapan hacia la bilis”, añadió la Dra. Whittle.
La detección de genes de resistencia a los antibióticos en todas las muestras de bilis infectada plantea que todos los pacientes del estudio albergaban naturalmente en su microbiota intestinal una resistencia a los antibióticos. Estas bacterias resistentes a los antibióticos también pueden escapar hacia la sangre y el resto del cuerpo, lo que potencialmente causaría una septicemia mortal.